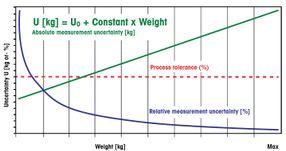
White Paper

Nutzen Sie unsere White-Paper-Suche oder wählen Sie weiter unten einen Schnelleinstieg, um sich gezielt White Paper nach Produkttyp, Anbieter oder Anwendung anzeigen zu lassen.
Die 10 neuesten White Paper

LADS – Labor-Schnittstelle der Zukunft bei 2mag verfügbar
Integrationskosten und -zeiten reduzieren durch Plug & Play bei Laborgeräteintegration
Mehr erfahren
Mit ChatGPT effizient den Laboralltag vereinfachen
Einfacher, schneller, effizienter
Mehr erfahren
Ohne modernes LIMS kein Labor der Zukunft?!
Anforderungen & Potenziale auf dem Weg zum Labor 4.0
Mehr erfahrenWhite Paper nach Anwendung
White Paper zu Produkttypen
Bewerben Sie Ihre White Paper auf chemie.de
Mit viel zeitlichem Aufwand schreiben Sie White Paper und Fachartikel und bieten diese auf Ihrer Website an. Doch die Zugriffszahlen sind ernüchternd. Was können Sie tun, damit Ihre White Paper mehr Interessenten erreichen?
Auf chemie.de mit über 6,5 Mio. Nutzern suchen Ihre potenziellen Kunden gezielt nach White Papern und Fachartikeln, die Methoden erklären und Anwendungen erläutern.
Sie erhalten hochwertige Sales-Leads
Sie positionieren Ihr Unternehmen als Experte auf Ihrem Fachgebiet
Einmal geschrieben, generiert Ihr Content immer wieder Sales-Leads
Neugierig? Jetzt mehr erfahren